亚马逊测评到底有没有必要?利弊在哪里?

在新冠疫情肆虐全球的背景之下,守望相助,共克时艰本应是主旋律,然而,现实的情况却是——中国支援日本的口罩,被美国抢了;瑞士购买中国的口罩和医用手套,被德国扣了;瑞士购买的消毒水又被意大利抢了。近日,德国海关又扣押了美国3M公司口罩和防护服……
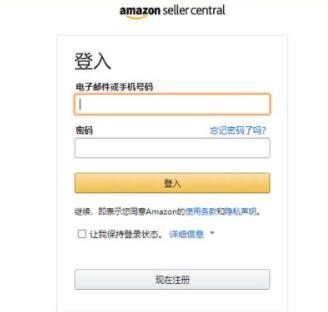
类似被抢和扣押新冠疫情医疗物资事件的轮番上演,令人瞠目。但从侧面也证实了目前海外疫情的严重程度以及对口罩和防疫物资的需求程度。截至3月24日10时23分,海外累计确诊病例已达284074例。
(来源:支付宝)
平台卖家转战独立站卖口罩,有工厂半天对接50万口罩订单
由于第三方平台对口罩上架进行严格限制,不少卖家纷纷寻求搭建独立站。不同于平台的繁琐,独立站对口罩的资质审核没那么严格,从网站搭建到产品的上架也仅需当天即可完成。为此,不少卖家将口罩生意瞄准了独立站。
美幻(上海)电子商务有限公司总经理蒋春风告诉雨果网,在独立站上销售口罩并不像卖家所说的没有要求。比如Shopify需要提供口罩产品合规资料、进货存货证明才能在平台上出售;使用PayPal收款的卖家,如果近期口罩的收款量显著增加,也需要向PayPal提供产品合规资料发货证明等才能再开售。目前,独立站上的口罩价格普遍比第三方平台上的高出30%,当然也有大的独立站价格相当低。
在引流渠道上,有部分卖家采用EDM邮件营销的形式或者靠自然流量吸引客户;有的依靠发Facebook、Google、Twitter等社交媒体或者搜索引擎,如微软必应进行口罩广告投放。有个别卖家通过投放额温枪、防护服等防疫产品广告,在链接关联产品上设置口罩购买入口,增加口罩曝光量和订单量,但此方法可能会被谷歌和Faceboo封杀;有的则是利用线上对接渠道出售,例如近期雨果网上线的跨境电商“防疫用品”供求对接平台,一家入驻的有资质的口罩供应商已经对接到来自波兰B端的50万口罩采购单。

Facebook等主流社交媒体严打口罩广告,卖家还如何引流?
但当越来越多的独立站站卖家投放口罩广告,Facebook、Google、Twitter等社交媒体开始禁止相关广告投放。如下所示:
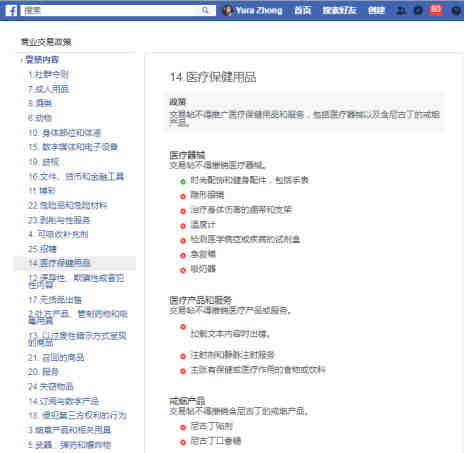
1、Facebook,禁止所有广告投放
禁止所有口罩广告投放,包括并且其他产品中涉及宣传肺炎相关产品和服务且具有误导性策略的广告。在3月27日之前,Facebook将会全部禁用有关医疗骗局危机(MSC)有关的账户。
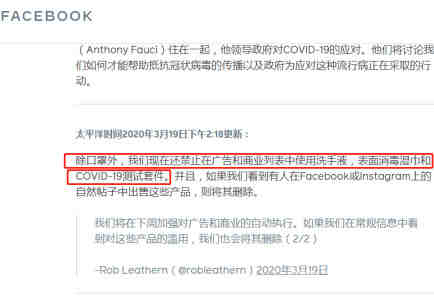
(图/Facebook官方截图)
2、Google,暂时禁止所有医用口罩广告
该限制目前仅适用于口罩,不适用于可以抵御其他疾病的产品广告,例如防护服和消毒剂等均可投放。谷歌表示,正在继续评估该禁令是否应适用于其他产品,并表示将花费几天时间来陆续删除平台上现有的口罩广告。
3、TikTok广告欧美地区已禁止投放:(目前能投放地区为日本、中国台湾)
以下是口罩广告的准入规则:
日本:没有准入限制,素材不能提及“coronavirus”,对口罩价格有严格的限制,其中普通口罩售价为100-200日元,N95口罩售价不能超过1000日元;如果有其他质量很好但是不是N95的,再单个看问题申诉。
中国台湾市场:普通口罩可以投,不需要资质,但是素材方面不可涉及coronavirus相关内容;医用口罩和N95都属于二三级医疗器械,需要投放主体为台湾当地医疗机构,且需要提供营业执照。
蒋春风表示,其在国内卖口罩时,曾通过抖音推广,但被限制7天只能操作一次。因此,其预测之后TikTok也有可能会禁止卖家投放广告。
雨果网了解到,除了这些明令禁止的社交媒体之外,目前微软必应也未对此类产品的广告有明确限制,除了口罩外,Bing上额温枪、防护服等广告词依旧可以投放。而Pinterest和Snapchat均可投放口罩口罩广告,但不能宣传恐慌、不能夸大功效、不能哄抬价格。
除社交媒体方面的严格管控之外,近日,Shopify自建站也表示,若部分售卖口罩、洗手液和卫生纸的卖家存在哄抬价格的行为,Shopify将暂时关停这些账号。而据卖家反馈,不少卖家就因违反Shopify AUP政策导致网站被封。
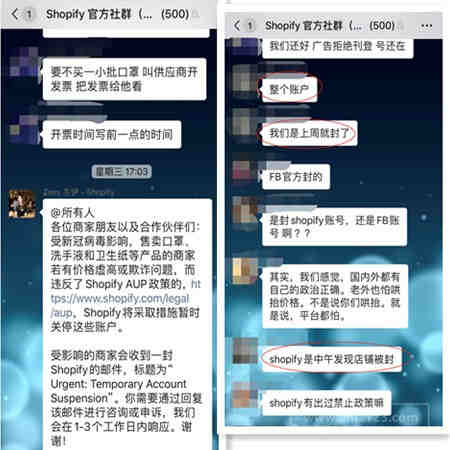
独立站大卖William表示,从Shopify卖家网站被封以及近期发生的事件可以明显感受到,自有独立站的优势更加凸显。虽然Shopify不能卖口罩,但是基于WordPress等建立的自有独立站依然可以。另外,目前除了Shopify自建站出台相关限制规则,其他自建站平台仍未有明文规定和限制。
放弃现有款做口罩,是赚钱还是被“割韭菜”?
由于当前独立站及部分第三方平台上仍有可出售口罩的空间,不少卖家为了保持资金收入、正常运转而放弃现有的产品,转往独立站出售口罩。对此,业内人士表示,一些专做鞋服以及户外等垂直类目产品的卖家受到的影响比较大,而对一些多平台、多站点布局的卖家来说,暂时放弃一款产品的销售,跟随大流卖口罩或许能够缓解资金问题。
但在SUGA苏嘉创始人Jaron Tam看来,放弃现有款式做口罩的行为是不理智的:
首先,虽然市场上有很多的卖家声称自己的口罩是“厂家直销”,但实际上都是“倒爷”。大部分的口罩卖家都是“搬运工”,因为没有自己的口罩生产商。对他们来说,不会有品牌或者产品的负担,但实际能挣到的利润也很低,除非走批发模式;
其次,如果卖家一直做“搬运工”,风险也很大。因为随着工厂复工生产力提升,口罩的产量随之上涨,竞争力下降。所以这种短期挣快钱的方式,最早卖口罩的那一批卖家确实有人赚到了,但后面进去的基本都是亏了;
再者,目前独立站的支付环节也是存在一定风险,预计PayPal和Stripe接下来也会进行限制,卖家的账号资金存在安全问题;
也有业内人士认为,虽然独立站没有品类和价格的限制,随着越来越多的商家涌入独立站,卖家需要考虑几点:
1、目前一些独立站平台上口罩的售价很低,卖家要确保自己能够拿到低价,否则竞争不过其他卖家;
2、Facebook、Google、Twitter等社交媒体对口罩广告都采取了限制,预计后续会有越多的社交媒体采取措施;
3、发货渠道,目前海外多个国家都关闭了边境,航空费用高涨、海运时效较低,如何组合物流渠道也需要卖家思考;
4、收款渠道,目前口罩独立站还可以通过PayPal收款,但是开通第三方信用卡需要提供网站进行审核并且需要一定的口罩类相关认证,若无法满足,后续将影响收款资金安全。
卖家出口口罩必备资质和条件
倘若跨境电商卖家仍想出口口罩,又该准备哪些资料以及出口到各国需要哪些条件呢?下面为雨果网整理的各项信息:
一、市场上防护口罩的CE证书
1、欧盟对于防护类口罩是规定分类是什么?
防护类口罩的等级分为FFP1、FFP2和FFP3都是防护类口罩的典型样式。防护类口罩适用的法规是 (EU) 2016/425个人防护装备法规,属于III类产品。测试标准为EN149:2001+A1:2009。
2、防护口罩进行CE认证的模式
根据 (EU) 2016/425 PPE法规的规定,防护类口罩必须获得Module B(型式检验认证)+ Module C2(内部质量控制+产品随机性监督抽查)or Module D(生产过程质量控制)证书后,方可在欧盟合法销售。
简单来说,就是必须Module B + Module C2 或 Module B + Module D二选一。
3、什么样的认证机构可以从事防护口罩的CE认证?
只有获得欧盟委员会 (EU) 2016/425 PPE法规口罩产品Module B、Module C2和/或Module D授权的认证公告机构才有权从事防护口罩的CE认证活动。
任何无PPE法规授权的认证公告机构、不具备Module B、C2和/或D资质的认证公告机构、不是认证公告机构的中介机构,都没有权力进行防护口罩的CE认证活动。
目前,国内暴露出来比较突出的问题是大量无资质的认证机构和中介机构,利用企业对于欧盟法规的不了解,误导企业进行错误的选择,签发了大量无效的CE证书,使得企业在出口欧盟过程中,面临了巨大的商业风险和法律风险。
确认一个认证公司是不是正规PPE CE认证机构,可以进行防护口罩CE认证活动的方法,共有四步。
第一步:查询欧盟官方网站查询公告机构信息
电脑端打开网址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=notifiedbody.main
所有具备欧盟委员会授权的认证公告机构都在这个网站上对外公示,您可以根据认证公告机构的编号,查询该机构的信息和授权范围。
第二步:确定认证公告机构是否具有PPE法规 (EU)2016/425授权
每个认证公告机构的授权范围不同,如果没有PPE法规 (EU)2016/425的授权,是无权进行防护口罩CE认证活动的,其签发的证书也是不符合欧盟法律规定的。
如果该机构具备PPE法规 (EU)2016/425的授权,其资质范围的展示如下:
![]()
第三步:确定认证公告机构是否具有呼吸防护的小类
PPE法规共有九大类产品授权,每个PPE认证公告机构的授权范围也是不同的,如果不具备呼吸防护的小类,即使是PPE认证公告机构,也不能从事防护口罩的CE认证活动。
查询方法,在官网上点开PPE授权右侧的“HTML”或“PDF”链接,查看是否有呼吸防护的小类授权,如下图红色框所示:
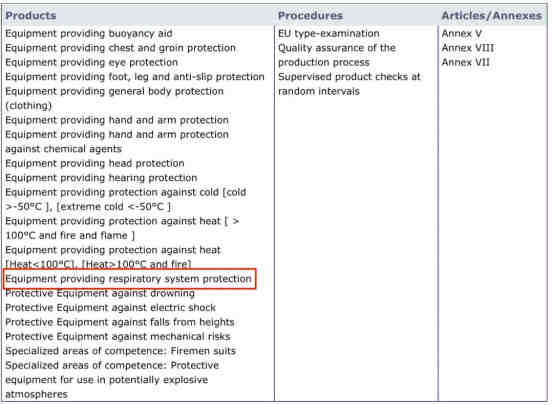
第四步:确认认证公告机构是否可以具备Module B、C2或D的授权
认证公告机构只有具备完整的Module B、C2和/或D资质,才有权签发Module B、C2和/或D证书。授权展示如下图红框所示:
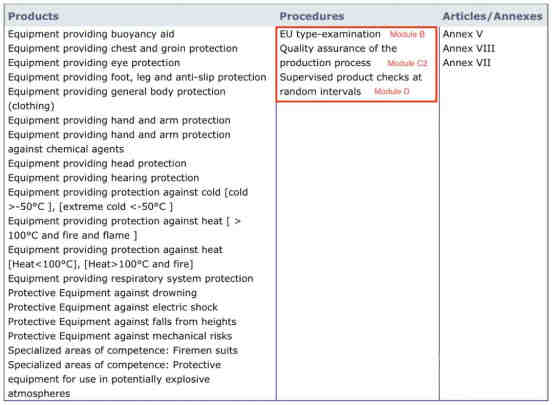
制造商只有在获得Module B + Module C2证书或Module B + Module D证书后,才可以进入欧盟市场合法销售。
如果认证认证公告机构只有部分Module B、C2或D的授权,那么他是没有权力签发无认可资质的证书的,企业持有其证书,也无法在欧盟市场合法销售。
二、出口前准备
1、明确口罩分类:国外按照用途一般分为个人防护和医用两类口罩。
2、国内出口贸易企业需具备的资质和材料
①、营业执照(经营范围有相关经营内容)。
②、企业生产许可证(生产企业)。
③、产品检验报告(生产企业)。
④、医疗器械注册证(非医用不需要)。
⑤、产品说明书(跟着产品提供)、标签(随附产品提供)。
⑥、产品批次/号(外包装)。
⑦、产品质量安全书或合格证(跟着产品提供)。
⑧、产品样品图片及外包装图片。
⑨、贸易公司须取得海关收发货人注册备案。
3、国内出口口罩生产企业资质证明
生产个人防护或者工业用非医疗器械管理的普通口罩,有进出口权的企业,可自行直接出口。
生产属于医疗器械管理的口罩用于出口,中国海关不需要企业提供相关资质证明文件,但一般进口国会要求生产企业提供产品三证,以证明该进口的商品在中国已合法上市,具体如下:
①、营业执照(经营范围包含有医疗器械相关,非医疗级别的物品不需要)。
②、医疗器械产品备案证或者注册证。
③、厂家检测报告。
生产企业有进出口权,可以自行出口,如没有进出口权,可以通过外贸代理进行出口销售。
4、内贸企业做出口需要取得的基本资质
①、 向市场监管部门取得营业执照,增加经营范围“货物进出口、技术进出口、代理进出口”。
②、 向商务部门取得进出口权,可直接在商务部业务系统统一平台(http://iecms.mofcom.gov.cn/)申请,网上提交材料。
③、 向外汇管理局申请取得开设外汇账户许可。
④、 办理进出口货物收发货人海关注册登记。
三、各国口罩准入条件产品准入条件
美国
必要资料:提单,箱单,发票。
个人防护口罩:必须取得美国 NIOSH检测认证,即National Institute for Occupational Safety and Health美国国家职业安全卫生研究所认证。
医用口罩:须取得美国FDA注册许可。
欧盟
必要资料:提单,箱单,发票。
个人防护口罩:个人防护口罩的欧盟标准是EN149,按照标准将口罩分为FFP1/FFP2和FFP3三个类别。所有出口欧盟的口罩必须获得CE认证证书。CE认证是欧盟实行的强制性产品安全认证制度,目的是为了保障欧盟国家人民的生命财产安全。
医用口罩:医用口罩对应的欧盟标准是EN14683。产品在欧盟销售需要出具欧盟自由销售证书 Free Sale Certificate,有了CE标志并进行了相关指令中要求的欧盟注册后,中国的制造商出口欧盟不需要自由销售证书。
日本
必要资料:提单,箱单,发票,日本国外的制造商必须向PMDA注册制造商信息。
口罩包装要求:包装上印有ウィルスカット(中文翻译:病毒拦截)99%的字样。
PFE:0.1um微粒子颗粒过滤效率
BFE:细菌过滤率
VFE:病毒过滤率
口罩品质标准
1、医用防护口罩:符合中国GB 19083-2010 强制性标准,过滤效率≥95%(使用非油性颗粒物测试)。
2、N95口罩:美国NIOSH认证,非油性颗粒物过滤效率≥95%。
3、KN95口罩:符合中国GB 2626 强制性标准,非油性颗粒物过滤效率≥95%。
韩国
必要资料:提单,箱单,发票,韩国进口商营业执照。
个人防护口罩标准:KF (Korean filter) 系列分为KF80、KF94、KF99
执行标准规范:MFDS Notice No. 2015-69
韩国医疗器械准入的法规门槛,基本分类为I、II、III、IV类,持证为韩国公司(License holder),韩国收货人需要到韩国药监局Korea Pharmaceutical Traders Association. 提前备案进口资质(没有不行)网址:www.kpta.or.kr。
澳大利亚
必要资料:提单,箱单,发票。
须通过澳洲的TGA注册,符合标准规范:AS/NZS 1716:2012,此规范是澳大利亚和新西兰的呼吸保护装置标准。
TGA 是Therapeutic Goods Administration的简写,全称是治疗商品管理局,它是澳大利亚的治疗商品(包括药物、医疗器械、基因科技和血液制品)的监督机构。澳大利亚对医疗器械分为I类,Is and Im, IIa, IIb, III类,产品的分类几乎和欧盟分类一致,如果产品已经获得CE标志,则产品类别可以按照CE分类。
四、各国注册、认证简要办理流程
美国NIOSH认证
需按照NIOSH的指南实施,企业需寄送样品至NIOSH实验室实施测试,同时提交技术性资料(包括质量体系部分资料)至NIOSH文审,只有文审和测试都通过,NIOSH才核发批文。NIOSH将其认证的防颗粒物口罩分为9类,具体的测试则由NIOSH下属的NPPTL (National Personal Protective Technology Laboratory)实验室操作。主要测试指标包括呼气阻力测试、呼气阀泄漏测试、吸气阻力测试、过滤效率测试。
美国FDA注册
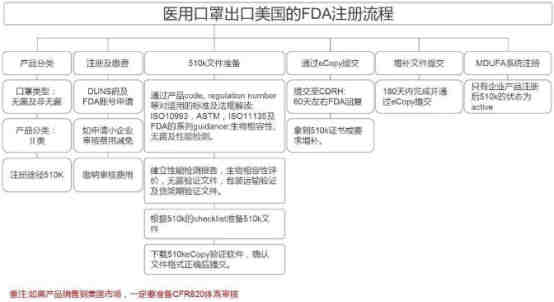
口罩出口通关申报超清晰指南(海关官方版)
欧盟CE注册
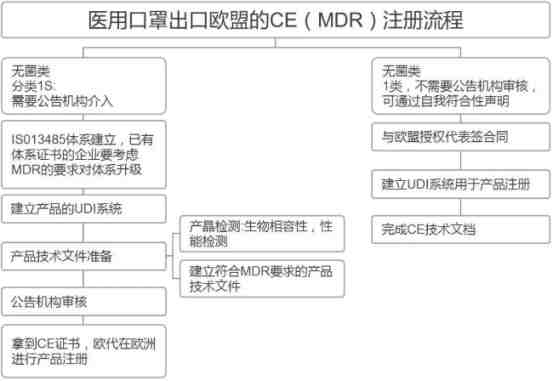
口罩出口通关申报超清晰指南(海关官方版)
日本PMDA注册
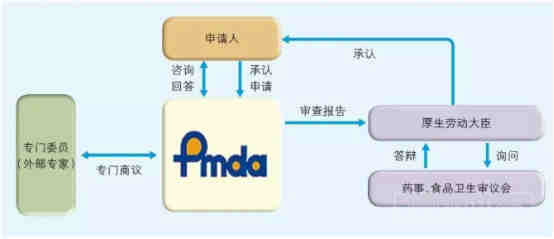
口罩出口通关申报超清晰指南(海关官方版)
1、准备阶段。确定产品分类(I,II特殊控制,II类控制,III,IV)和产品JMDN编码,选择MAH(日本持证方);
2、制造商向PMDA注册工厂;
3、II类特殊控制产品向授权认证机构PCB申请QMS工厂审核,其他II类产品和III类IV类产品向PMDA申请QMS工厂审核,并获得QMS证书;
4、申请Pre-Market Apporval证书,II类特殊控制由PCB发证,其他II类产品和III类IV类产品控制由MHLW(厚生劳动省)发证;
5、支付申请费用;
6、注册文件整改,注册批准;
7、所有类别产品均需要MAH向RBHW(厚生省地区机构)进行进口通报注册后才能进口销售。
韩国KFDA注册
韩国卫生福利部(MinistryofHealthandWelfare,MHW),简称卫生部,主要负责管食品、药品、化妆品和医疗器械的管理,是最主要的卫生保健部门。依照《医疗器械法》,韩国卫生福利部下属的食品药品安全部负责对医疗器械的监管工作。KFDA注册流程为:
1、 确定产品分类(I,II,III,IV),选择KLH(韩国持证方);
2、II类产品需申请KGMP证书和接受现场审核,II类产品一般是授权的第三方审核员,并获得KGMP证书;
3、II类产品需要送样品到韩国MFDS授权的实验室进行韩国标准的测试;
4、由KLH向MFDS(韩国食品药品安全部)提交技术文件(检测报告,KGMP证书等),进行注册审批;
5、支付申请费用;
6、注册文件整改,注册批准;
7、指定韩国代理商和经销商,产品销售。
澳大利亚TGA注册
依据Australian Therapeutic Goods (Medical Devices) Regulations 2002,澳大利亚对医疗器械分为I类,Is and Im, IIa, IIb, III类,产品的分类几乎和欧盟分类一致,如果产品已经获得CE标志,则产品类别可以按照CE分类。如果已经获得欧盟公告机构(Notified Body)签发的CE证书,是可以被TGA认可的,并可以作为满足澳大利亚安全法规的重要注册资料。

口罩出口通关申报超清晰指南(海关官方版)

我们建了一个亚马逊卖家交流群,里面不乏很多大卖家。
现在扫码回复“ 加群 ”,拉你进群。
热门文章
*30分钟更新一次