Facebook广告竞价策略介绍,不花冤枉钱

有些朋友私信小编
说自己是生产售卖医疗器械的,
想知道产品出口到美国为什么必须要做FDA认证?
在国内进行招投标FDA还是甲方的硬性要求,
FDA对产品来说到底有多重要?
下面小编就详细讲讲医疗器械的FDA认证。
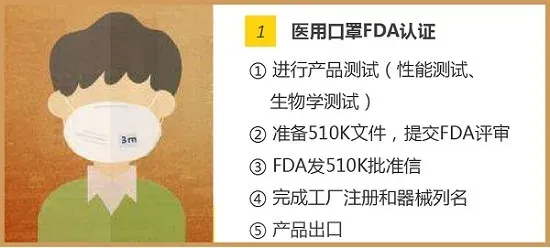
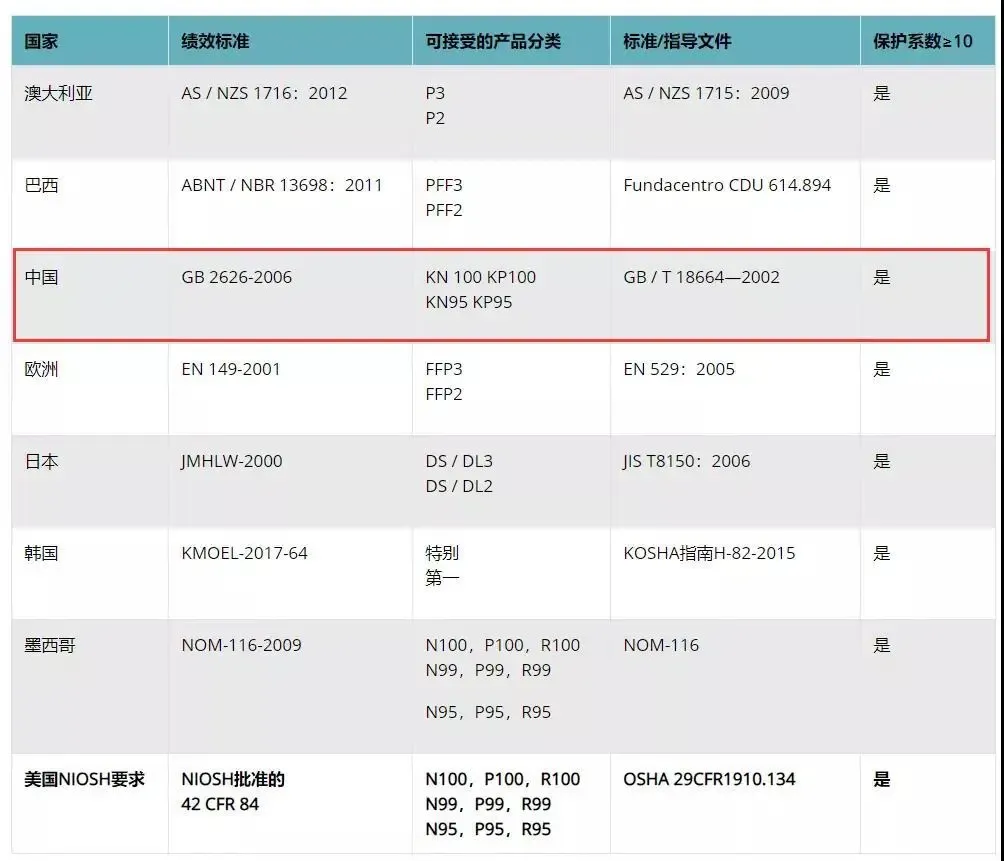
FDA(美国食品和药物管理局Food and Drug Administration)对医疗器械的管理通过器械与放射健康中心(CDRH)进行的,中心监督医疗器械的生产、包装、经销商遵守法律下进行经营活动。 医疗器械FDA认证:根据医疗用途对人体可能的伤害,FDA将医疗器械分为I、II、III类,越高类别监管越多。 一次性口罩、防护服属于医疗器械I类 一次性口罩,属于FDA医疗器械I类,只需要按照FDA要求做FDA认证即可,流程为:①填写FDA申请表格,信息确认;②获取PIN码,交付年费5236美元;③下发注册号;④产品出口。 医用口罩、额温枪属于医疗器械II类 美国对于医用口罩、额温枪的管理机构是FDA,分类都属于医疗II类,都需要申请510K批准。以出口医用口罩为例,FDA认证流程为: N95口罩属要做NIOSH认证 NIOSH将口罩分成N95、N99、N100、R95、R99、R100、P95、P99、P100合计9个类别。从某种意义上来说,N95算是其中防护级别比较低的品类。NIOSH的口罩防护等级认证程序复杂,流程总结为: 2020年3月17日美国疾控中心(CDC)公布了“优化N95呼吸器供应的策略:危机/替代策略”,批准了其它国家与N95同级别的口罩可以在美国替代使用,名单中包含巴西、韩国、日本、澳大利亚、欧洲、墨西哥和中国(含国内的四个口罩型号:KN100, KP100, KN95, KP95),共七个国家和地区。 3月25日,美国FDA更新了Non-NIOSH批准口罩的紧急使用许可EUA。该指南将中国排除在Non-NIOSH的国家名单之外。包括KN95、KP100、KN100和KP95中国制造的口罩都将不在EUA名单之列。 洗手液/消毒液——非处方药FDA认证 不需做新药论证,但需提供充分材料,依法规认定有效成分。在达到FDA各项非处方用药的要求,并获得美国药口品登记号(NDC)后可以在美国市场上以药品定位销售。 如何确定某产品是真的通过美国FDA认证 ? 通过产品持有者号,在美国FDA官网可以查询是否通过了认证。







我们建了一个亚马逊卖家交流群,里面不乏很多大卖家。
现在扫码回复“ 加群 ”,拉你进群。
热门文章
*30分钟更新一次