创业过的人再上班什么感觉?乐外卖有话说

什么是 CE 标志(标记) ?
CE 标志,英文为 CE Marking 是一个28个欧洲国家强制性地要求产品必须携带的安全标志, 其型如 。字母 “CE” 是法文句子 “Conformité Européene” 的缩写。其意为 “符合欧洲 (标准)”。CE 标志(标记) 最初所使用的英文术语为 “EC Mark”,该术语于1993年签署的欧盟产品指令第93/68/EEC号中正式被术语 “CE Marking” 所取代。现在,所有的欧盟官方文件中均使用术语 “CE Marking”。
为什么要加贴CE标记?
随着中国对外贸易的大步发展,中国的产品越来越多的走向欧洲,与此同时,欧盟为规范其市场,统一产品标准和规范,规定在欧盟市场“CE”标志属强制性认证标志,不论是欧盟内部企业生产的产品,还是其他国家生产的产品,要想在欧盟市场上自由流通,就必须加贴“CE”标志,以表明产品符合欧盟《技术协调与标准化新方法》指令的基本要求。这是欧盟法律对产品提出的一种强制性要求。
哪些产品需要做CE认证?(CE指令)
燃气炉具 Appliances Burning Gaseous Fuels (AppliGas)
载人的索道装置 Cableway Installations to Carry Persons
低电压电气设备 Low Voltage Electrical Equipment
建筑产品 Construction Products
使用于具有爆炸性环境中的设备和防护系统 Equipment and Protective Systems for Used in Potentially Explosive Atmospheres (Atex)
民用爆破器材 Explosives for Civil Uses
燃烧液体或气体燃料的热水锅炉 Hot Water Boilers
家用电冰箱或电冷柜 Household Refrigerators & Freezers
升降机 Lift
机械 Machinery
航海设备 Marine Equipment
(普通)医疗器械 Medical Devices
主动可植入医疗器械 Active Implantable Medical Devices
体外诊断医疗器械 In Vitro Diagnostic Medical Devices
非自动称量仪器 Non-automatic Weighing Instruments
无线电及电信终端设备 Radio Equipment & Telecommunications Terminal Equipment (R&TTE)
个人防护设备 Personal Protective Equipment (PPE)
简单压力容器 Simple Pressure Vessels
压力设备 Pressure Equipment
休闲用船只 Recreational Craft
玩具 Toys
电磁兼容 Electromagnetic compatibility
欧盟如何定义医疗器械产品
‘medical device’ means any instrument, apparatus, appliance,software, material or other article, whether used alone or in combination,including the software intended by its manufacturer to be used specifically for diagnostic and/or therapeutic purposes and necessary for its proper application, intended by the manufacturer to be used for human beings for the purpose of:
— diagnosis, prevention, monitoring, treatment or alleviation of disease,
— diagnosis, monitoring, treatment, alleviation of or compensation for an injury or handicap,
— investigation, replacement or modification of the anatomy or of a physiological process,
— control of conception,
and which does not achieve its principal intended action in or on the human body by pharmacological, immunological or metabolic means, but which may be assisted in its function by such means;
‘accessory’ means an article which whilst not being a device is intended specifically by its manufacturer to be used together with a device to enable it to be used in accordance with the use of the device intended by the manufacturer of the device;
医疗器械产品如何加贴CE
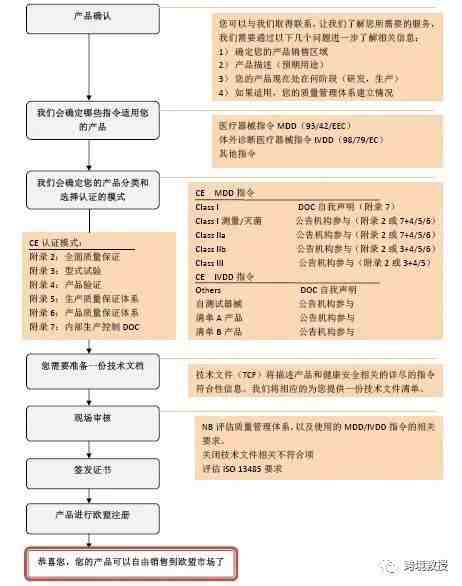
注:只有1类产品才要求欧盟注册,I*,IIA,IIB,III类产品获得公告机构证书即可在欧盟地区自由销售。
MDR
1、技术文件的要求
MDR中添加了对技术文件内容的要求;且明确指出上市后监管计划和安全性更新报告(PSUR)都是技术文件的一部分,并要求依据上市后监管体系收集的资料对技术文件中相应信息进行更新。
2、技术文件的基本内容
器械说明与性能指标
包括变型和附件包含器械说明与性能指标,以及引用的前代和类似器械的信息。
制造商提供的信息
设计与制造信息
通用安全与性能要求
包含其符合附录I提供的通用安全与性能要求的证明资料。
风险利益分析和风险管理
产品验证与确认
临床前和临床数据(包含临床评价计划/报告,PMCF计划/报告);以及针对含药器械、人体/动物来源组织或其衍生物制备的器械、引入人体并被吸收器械、具有测量功能器械等的相关附加信息
3、上市后监管的技术文件
AnnexIII TECHNICAL DOCUMENTATION ON POST-MARKET SURVEILLANCE 详细说明了要按照Article83-86 编写上市后监管的文件,包含上市后监管计划、上市后监管报告或定期安全性更新报告(PSUR)。
4、符合性声明文件
ANNEX IV EU DECLARATION OF CONFORMITY 详细说明了“符合性声明”文件包含的内容。
5、加强器械上市后监管体系
Chapter VII POST-MARKET SURVEILLANCE, VIGILANCE AND MARKET SURVEILLANCE 着重说明上市后监管、警戒和市场监管。
建立、实施和维护上市后监管体系(见Article83)。
强调上市后监管体系贯穿整个生命周期,并不断更新。
建立“上市后监管计划”(见Article84),具体内容见Annex III。
I类器械编写“上市后监管报告”(见Article85)。
IIa、IIb和III类器械编制“定期安全性更新报告(PSUR)”(见Article86)。
PSUR需定期更新并作为技术文件的一部分。
建立警戒和上市后监管电子系统(见Article 92)。
在整个器械使用寿命期间,依据实施PMCF后取得的临床数据对临床评价及技术文件进行更新(Annex XIV part B)。
6、完善临床评价相关要求
新法规提出:
要求根据Article61和附录XIV partA执行、评估、报告和更新临床评价资料;
提出对特定III类和IIb类器械,CER中要考虑咨询专家小组的意见;
对植入和III类器械,提出考虑临床研究;
要求CER按照PMCF取得数据进行更新;
针对III类和可植入器械,提出了CER更新的频率;
明确证明实质等同性需考虑的特点;
要求其与风险管理的相互作用
7、Eudamed数据库
新法规提出:
明确欧洲医疗器械数据库(Eudamed)建立目的和包含的信息(Article 33);
信息的公开性:
要求III类器械和植入式器械,安全和临床性能信息通过Eudamed向公众开放。
8、提出器械的可追溯性(UDI)
除定制和研究器械外,其他器械均需建立UDI系统;
UDI信息体现在标签或包装上(不包含集装箱);
UDI-DI信息需要载明于符合性声明中(见Article27);
Annex VI Part B提出UDI-DI包含的信息;
可植入、重复使用、软件、可配置器械的UDI有特殊要求(见Annex VI Part C)
包装或标签上UDI实施的时间见Article123 (f)。
UDI 发行实体由欧盟委员会指定。
过渡性:Article 120指出“在委员会根据第27(2)条指定发行实体前,GS1、HIBCC和ICCBBA应被视为指定的发行实体”。
9、对NB提出的严格要求
对“公告机构”,新版MDR花费大篇幅对其进行职能和要求进行描述;各NB需按照附录VII的要求重新申请MDR的三方审核的授权
欧盟如何对医疗器械进行分类
医疗器械指令 MDD 93/42/EEC 附录九中详定18条规则,按医疗产品的危险程度,将产品分为I类, IIa类, IIb类, III类。
1 非侵入武器械
1.1 规则1
所有非侵入式器械均属于第Ⅰ类,除非下列规则之一适用。
1.2 规则2
用于导引或储存血液、体液或人体组织、液体或气体供最终注入、施人或导入人体的所有非侵入式器械:
——如果它们可以连接第Ⅱa 类或更高类别的有源医疗器械;
——如果它们预定用于储存或导引血液或其他体液,或用于储存器官、部分器官或人体组织。
属于第Ⅱa 类,而在所有其他情况下则属第Ⅰ类。
1.3 规则3
用于改变注入人体的血液、其他体液或其他液体的生物或化学成分的所有非侵入式器械为第Ⅱb 类。如果治疗包括过
滤,离心或气体、热交换,则该器械属第Ⅱa 类。
1.4 规则4
与受伤皮肤接触的所有非侵入武器械:
——如果是用作某种机械屏障,用于挤去或吸收渗出液,则为第Ⅰ类;
——如果主要用于只能经二期愈合治愈的皮肤创伤,应归为第Ⅱb 类;
——在所有其他情况下,包括主要用于控制创伤的微生物环境的器械,均为第Ⅱa 类。
2 侵入式器械
2.1 规则5
所有用于人体孔道,不与有源医疗器械连接的非外科侵入式器械:
——如果是为短暂使用的,应为第Ⅰ类;
——如果是短时间使用的,应为第Ⅱa 类。但用于口腔至咽部、耳道至耳鼓或鼻腔的除外,在这几种情况下,器械属
第Ⅰ类;
——如果是长期使用的,为第Ⅱb 类。但用于口腔至咽部、耳道至耳鼓或鼻腔、且不易被粘膜吸收的除外,在这几种
情况下,器械应属于第Ⅱa 类。
所有作用于人体孔道,但与第Ⅱa 类或更高类别的有源医疗器械连接的非外科侵入式器械,属第Ⅱa 类。
2.2 规则6
所有短时间使用的外科侵入式器械,应为第Ⅱa 类。但以下情况除外:
——通过直接与人体心脏或中枢循环系统接触,用于诊断、检查或矫正这些部位的缺损的器械,应为第Ⅲ类;
——可重复使用的外科器械,应为第Ⅰ类;
——以电离辐射形式提供能量的器械应为第Ⅱb 类;
——具有生物效应或可被全部或大部吸收的器械,应为第Ⅱb 类;
通过一种递送系统施药的器械,如果这种施药方式具有潜在危险,则应为第Ⅱb 类。
2.3 规则7
短期用的所有外科侵入式器械,应为第Ⅱa 类,但以下情况除外:
——通过直接与人体心脏或中枢循环系统接触,专门用于诊断、检查或矫正这些部位的缺损的器械,应为第Ⅲ类;
——或专门用于直接与中枢神经系统接触的器械,也应属于第Ⅲ类;
——或以电离辐射方式提供能量的,为第Ⅱb 类;
——或具有生物效应或全部或大部被吸收的,为第Ⅲ类;
——或在体内经历化学变化的(但放在牙齿中的除外),或施药的,应为第Ⅱb 类。
2.4 规则8
所有植入式器械和长期使用的外科侵入式器械,为第Ⅱb 类,但预定:
——放在牙齿中的,应属于第Ⅱa 类;
——用于直接与心脏,中枢循环系统或中枢神经系统接触的,为第Ⅲ类;
——具有生物作用或可全部或大部被吸收的,为第Ⅲ类;
——或在体内经历化学变化(但放在牙齿中的除外),或用于施药的,应为第Ⅲ类。
3 有源器械的附加规则
3.1 规则9
用于控制或交换能量的所有有源治疗器械,应为第Ⅱa 类。除非其特性使它们控制或交换出入人体的能量的方式可能
具有潜在的危险性,则根据所用能量的性质、强度和部位,这些器械应归为第Ⅱb 类。
用于控制和检测第Ⅱb 类有源治疗器械或直接影响这类器械性能的所有有源器械为第Ⅱb 类。
3.2 规则10
用于诊断的有源器械在下列情况下为第Ⅱa 类:
——如果是用于提供可被人体吸收的能量,但用于以可见光谱照射患者身体的器械除外;
——如果是用于体内放射性药物分布成像;
——如果是用于直接诊断或监视生命生理过程,除非它们专门用于监测生命生理参数时,参数变化的性质可能导致
对患者的突发性危险,例如:心脏机能,呼吸,CNS 活动的变化,则器械属于第Ⅱb 类。
用于发射电离辐射的和用于介入诊断和治疗放射学的有源器械,包括控制或检测这类器械或直接影响其性能的器械,
均属于第Ⅱb 类。
3.3 规则11
所有用于向人体施与药物、体液或其他物质和/或从人体清除药物、体液或其他物质的有源器械都属于第Ⅱa 类,除
非考虑到有关物质的性质、有关的人体部位及施与的方式,其采用的方式具有潜在的危险,在这种情况下应属于第Ⅱb 类。
3.4 规则12
所有其他有源器械属于第Ⅰ类。
4 特别规则
4.1 规则13
所有包含某种物质的器械如果作为其组成部分单独使用时,按65/65/EEC 指令的定义可视为药品,且对人体能起到
辅助该器械的作用,属于第Ⅲ类。
4.2 规则14
用于避孕或防止性病传播的所有器械属于第Ⅱb 类,如果这些器械是植入式的或长期侵入式的,则应属于第Ⅲ类。
4.3 规则15
专门用于消毒、清洁、冲洗、或适当时使隐形眼镜水合的所有器械属于第Ⅱb 类。
专门用于消毒医疗器械的所有器械为第Ⅱa 类。
本规则不适用于通过物理作用清洗除隐形眼镜以外的医疗器械的产品。
4.4 规则16
专门用于X 射线诊断成像记录的有源器械为Ⅱa 类。
4.5 规则17
利用动物组织或不能存活的衍生物制造的所有器械,除了用于接触未受损皮肤的以外,属于第Ⅲ类。
4.6 规则18
作为其他规则的例外,血袋属于第Ⅱb 类。
医疗器械CE认证所需技术文件清单
Listing of required documentation in a Technical Construction File for CE marking acc. to 93/42/EEC
按照93/42/EEC进行CE 标志认证所需要提供的技术文档清单
1. General description of the device 器械的一般描述
包括产品的型号、规格,产品在国内的注册和生产状况等。
2. Description of intended use预期用途的描述
Class of device, 设备的分类
applied classification rule and justification选择分类的规则和依据
3. Description of accessories (if applicable)附件的描述(如适用)
产品的附件清单,附件的更换描述。
4. Description of manufacturing methods and controls:生产方法和控制的描述:
a) Description of process过程的描述
b) List of procedures and instructions程序和说明的列表
c) Provisions to control subcontractors供应商控制的规定
5. Answers to essential requirements对基本要求的符合性
6. List of applied standards适用标准清单
7. Risk analysis 风险分析(参考EN 14971:2007)
8. Specification of materials 材料的详细说明
9. Photos, drawings and diagrams 照片、图纸和原理图
10. Labelling 标签(参考EN 980:2007)
11. Description and Validation of Packaging 包装的描述和确认
12. Instructions for use 说明书
13. Lifetime and/or shelf-life 使用期限和/或保存期限
14. Sterilization validation (if applicablee) 灭菌确认(如适用)
15. Software validation 软件确认(参考EN 60601-1-4:1996)
16. Usability / ergonomics (if applicablee) 实用性 /人体工学(如适用)(参考EN 60601-1-6:2007)
17. Preclinical evaluation (if applicable) 临床前评价(如适用)
(Test reports electrical / mechanical / biocompatibility / animal testing / issued by accredited third party laboratories)由认可的第三方实验室颁发的(电气 / 机械 / 生物相容性 / 动物实验)测试报告
18. Clinical evaluation (clinical tests and/or literature with critical evaluation) 临床评价(临床测试 和/或关键的文献评价)
19. Project for EC declaration of conformity EC符合性声明项目
Only for non-European manufacturers: Contract with EC Representative
仅适用于非欧洲制造商:与欧盟授权代表的合同
end·

我们建了一个亚马逊卖家交流群,里面不乏很多大卖家。
现在扫码回复“ 加群 ”,拉你进群。
热门文章
*30分钟更新一次